免疫组织化学(Immunohistochemistry,IHC),指在组织细胞原位通过抗原抗体反应和呈色反应,借助可见的标记物,对相应的抗原或抗体进行定位、定性和定量检测的一种免疫检测方法。
组织或细胞中凡是能作为抗原或半抗原,如蛋白质、多肽、氨基酸、多糖、磷脂、受体、酶、激素、核酸及病原体等都可用相应的特异性抗体进行检测。
原理:通过免疫学中抗原抗体结合反应,用特异性抗体(单克隆或多克隆)检测组织、细胞内相应的抗原物质,形成抗原-抗体复合物;此复合物上带有事先标记的标记物通过与标记物相对应的检测系统,如酶底物显色反应可使之呈现某种颜色,从而可检测组织细胞内的抗原,以达到诊断、鉴别诊断和研究的目的。
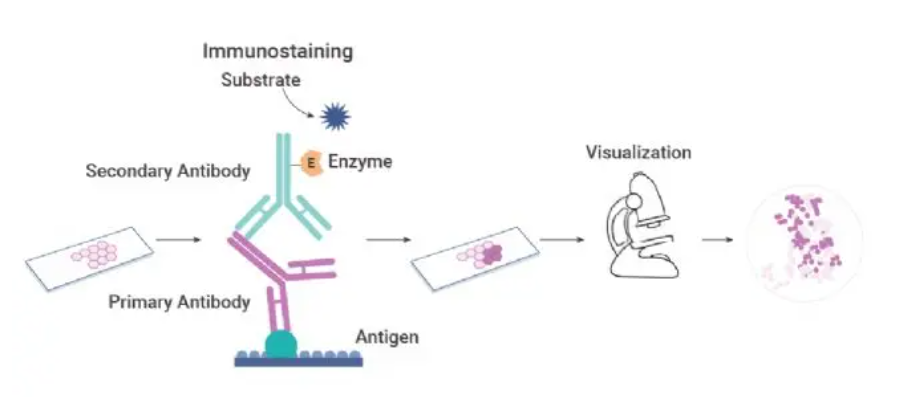
图1 免疫组化原理图
IHC 检测可分为直接法(又称一步法)和间接法(二步、三步或多步法)。直接检测方法是直接与偶联物 (例如荧光染料、酶、胶体金或生物素) 结合标记的一抗的一步过程。直接法快速,但对于检测常规处理的组织中的大多数抗原缺乏足够的灵敏度。
间接法的灵敏度高于直接法:未标记的一抗保留了完全的亲和力,具有更强的抗原结合力,并且每分子一抗的标记物(例如过氧化物酶)数量更多,从而增加了反应强度。
间接法可以用较少的一抗检测较少量的抗原,用于放大一抗信号,因为一个一抗至少可以结合两个带标记的二抗。
二抗的选择,取决于一抗的种属来源、反应物种、类别亚型、二抗形式、偶联标记形式。
免疫组化通常采用F(ab') 形式的片段酶标(HRP/AP)/生物素标记二抗。
在研究某些细胞(如巨噬细胞、B细胞、自然杀伤细胞等)和组织(如淋巴结,脾脏,外周血等)时,这些细胞或组织因表面Fc端受体过多,会与抗体分子中的Fc端相结合,从而导致非特异性结合和高背景的现象,俗称“假阳性”。
使用F(ab') 形式的二抗可以避免其与活细胞中的Fc受体非特异性结合,还可避免与Protein A、ProteinG的非特异性结合,从而提高实验准确性。