实验步骤:
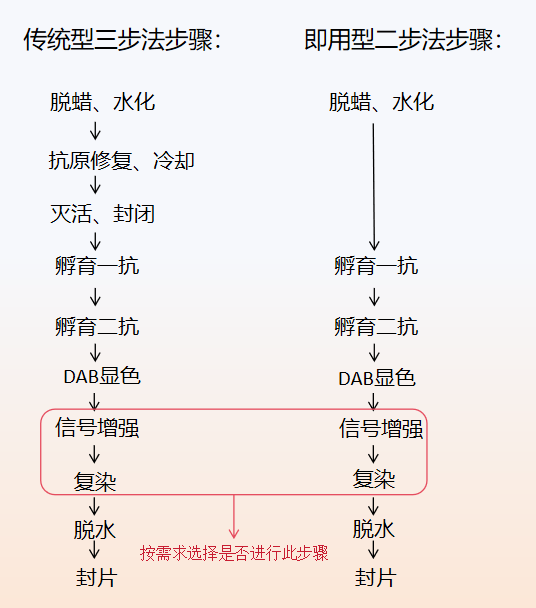
图1 IHC实验流程图
1.脱蜡、水化
脱蜡:样品置于二甲苯中浸泡,以溶解石蜡,可多次浸泡以保证石蜡去除完全。注意:脱蜡不完全会影响抗体结合和染色效果。
水化:依次置于梯度酒精中各浸泡5-10min。注意:在此过程中需保证切片处于湿润状态。
2.抗原修复、冷却
抗原修复:是甲醛固定—石蜡制片的标本进行免疫组织化学检测的一种增进检测灵敏度的方法。目的:提高抗原-抗体结合率。
通过加热或酶消化的方法,可使标本中待检分子的抗原决定簇恢复固定前的空间结构特点。除了石蜡切片,经甲醛固定的冷冻切片,如果检测灵敏度不足,有时也可进行抗原修复。
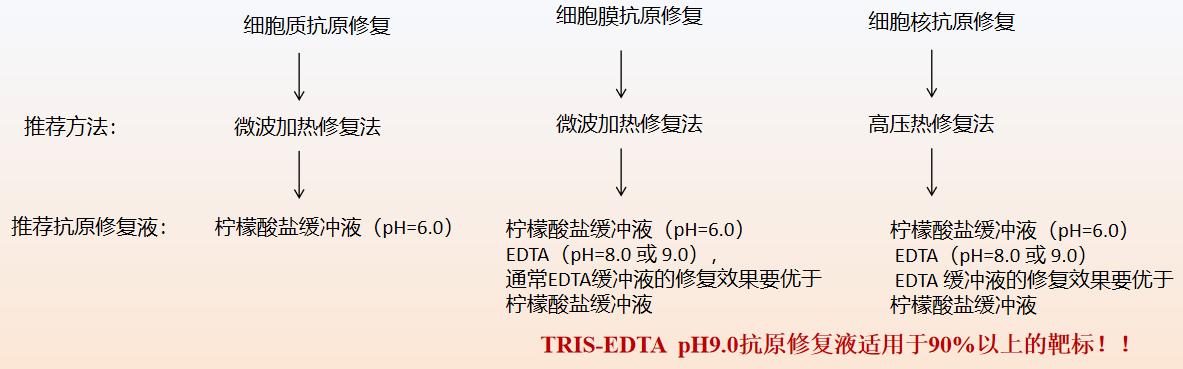
抗原修复液的选择:根据抗原的不同,修复方法的不同选择不同的抗原修复液。
3.灭活、封闭
使用3%过氧化氢水溶液室温孵育10min,去除内源性过氧化物酶。3%过氧化氢水溶液现用现配,注意孵育时间,孵育时间过长会导致脱片。如含有内源性碱性磷酸酶的部分组织,可用左旋咪唑进行灭活。灭活后PBS充分洗涤。
使用封闭液(5% BSA/血清)覆盖样品,放入湿盒中,在室温或37°C 下孵育30 min,PBS充分洗涤。
4.孵育一抗
选择抗体稀释液/PBS稀释抗体至合适浓度,均匀的覆盖样品,放入湿盒中4℃过夜,或室温孵育1-5h,PBS充分洗涤。
5.孵育二抗
选择抗体稀释液/PBS稀释抗体至合适浓度,均匀的覆盖样品,室温孵育30-90min,PBS充分洗涤。
6. DAB显色
显色检测中需要考虑的其他因素有酶和显色底物的选择。每种检测酶都有几种不同的显色剂。HRP-DAB是最常用的显色剂组合。加入酶的底物,底物在酶的作用下发生化学反应,形成有色沉淀物,通常呈现棕色 或蓝色。通过显微镜观察组织切片上的颜色变化,可以确定抗原在细胞或组织中的位置和表达水平。
7.信号增强
为提高免疫组化的灵敏度和特异性,可选择性的使用免疫组化信号增强剂。
8.复染
为了形成细胞轮廓,更好的定位目标蛋白,可进行复染。滴加 80-100 μL 苏木素染色液至完全覆盖组织,室温孵育5 min,自来水冲洗返蓝。
9.脱水、透明
依次使用梯度酒精浸泡以去除水分,而后浸泡二甲苯。
10.封片
滴加封片剂至组织上,盖玻片轻轻覆盖,需确保切片上没有气泡产生,通风橱中过夜后可长期保存。